Tıbbi Cihazların Biyolojik Değerlendirmesi
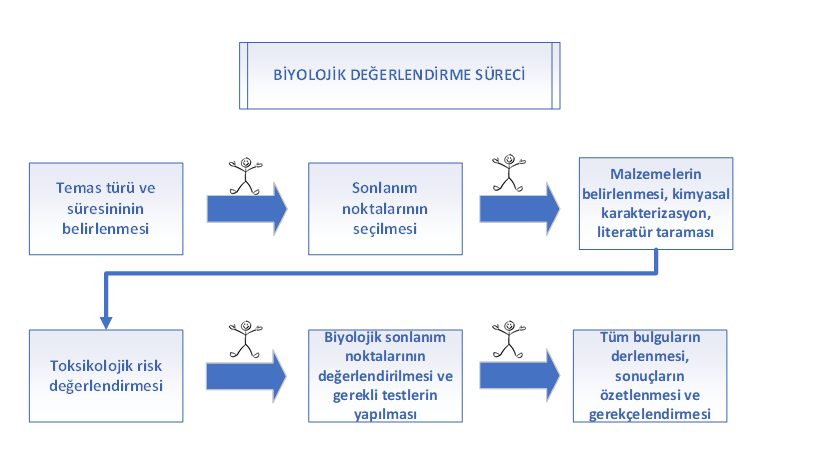
Bir tıbbi cihazı piyasaya sürmeden önce, çoğu otorite, üreticilerin cihazın biyolojik güvenliğini kapsamlı bir şekilde değerlendirmesini şart koşar. Bu süreç, cihazın insan vücudu ile uyumsuzluk riskinin en aza indirilmesini amaçlar. ISO 10993 standart serisi, biyolojik riskleri kabul edilebilir bir fayda/risk oranına indirgeyerek tıbbi cihazların biyouyumluluğunu kanıtlamaya yönelik gereklilikleri belirtir. Biyolojik değerlendirme süreci, risk yönetimi süreci ile birlikte yürütülmelidir. Değerlendirme, malzeme karakterizasyonu ve/veya belirli biyolojik testlerin yapılmasını gerektirebilir. Üreticilerin hem ISO 10993 hem de ISO 14971 gereklilikleri ile uyumlu bir biyolojik değerlendirme planı oluşturması bu kapsamda önem arz etmektedir.
Üreticiler, biyolojik değerlendirme süreçlerini belgeleme sorumluluğuna da sahiptir. Bu dokümantasyon, tıbbi cihazın biyolojik özelliklerinin değerlendirilmesi, malzeme seçimi, malzeme karakterizasyonu ve biyouyumluluk testleri aracılığıyla biyolojik güvenliğin doğrulanmasını desteklemek için gereklidir. Test programından elde edilen bulgular biyolojik değerlendirme raporunda sunulmalı ve tartışılmalıdır.
Biyolojik değerlendirme sürecinin durağan olmadığını unutmamak gerekir; cihazın tasarım veya üretim süreçlerinde değişiklikler olduğunda, biyolojik değerlendirme yeniden gözden geçirilmelidir. Pazar sonrası güvenlik verileri sonrasında potansiyel bir risk ile karşılaşılırsa biyouyumluluk değerlendirmesinin yeniden yapılmasını gerekebilir. Aynı zamanda, üreticilerin biyolojik değerlendirmelerini güncel standartlar ve test yöntemleriyle uyumlu tutmaları da gerekmektedir.
Temas Türü ve Süresi
Biyolojik değerlendirme sürecinin başlangıcında en önemli adımlardan biri, tıbbi cihazın temas ettiği anatomic bölge, temas sıklığı ve süresinin belirlenmesidir. Vücut içi sıvılar ve dokularla uzun süre temas eden cihazlar, sadece yapısı bozulmamış deri ile kısa süreli temas eden cihazlara kıyasla daha fazla biyolojik risk taşır.
Bir tıbbi cihazın temas süresini belirlerken dikkate alınması gereken en kritik noktalardan biri, tekrarlı kullanım durumudur. Birden fazla kez kullanılanılan cihazlar için, tıbbi cihazın kategorize edilmesi sürecinde bu tıbbi cihaza maruz kalma süresi ve sıklığı dikkate alınarak toplam süre belirlenmeli ve değerlendirilmelidir. Bu kümülatif yaklaşım, özellikle dokular ile sık temas eden cihazlar için önemlidir, çünkü tekrarlanan maruziyetler olumsuz biyolojik etkilerin riskini artırabilir.
Cihazın temas süresi ve türü belirlendikten sonra, ISO 10993-1 standardının Ek A kısmında bulunan yönlendirmelere göre cihaz için gerekli biyolojik sonlanım noktaları seçilebilir.
Malzeme Seçimi
Biyolojik değerlendirme süreci, tasarım aşamasında tıbbi cihaz için en uygun malzemelerin seçilmesini konusunda da önemli rol oynar. Biyolojik değerlendirme planında, bu malzemelerin her biri; kimyasal bileşen bilgisi, tedarikçi bilgileri ve kullanılan renklendiriciler veya katkı maddeleri gibi ayrıntılar da dahil olmak üzere açıkça belgelenmeli ve tanımlanmalıdır.
Tıbbi cihaz için malzemeler iyi tanımlanmış olsa bile, nihai üründe yalnızca bu malzemelerin bulunduğunu kesin olarak söylemek mümkün olmayabilir. Tıbbi cihazın üretim sürecinde kullanılan çeşitli üretim kimyasalları veya ajanlarının varlığı da göz önünde bulundurulmalıdır. Bu nedenle, biyolojik değerlendirme planında hem tıbbi cihaz malzemeleri hem de üretim süreçleri ayrıntılı olarak incelenmelidir.
Kimyasal Karakterizasyon ve Toksikolojik Risk Değerlendirmesi
ISO 10993-1 standardı, ISO 10993-18'e uygun olarak kimyasal karakterizasyon yoluyla cihaz bileşenlerinin ve üretim kalıntılarının tanımlanması gerektiğinden bahsetmektedir. ISO 10993-18 standardınındaki gereklilikler, bitmiş üründe bulunan malzemelerin hem niteliksel hem de niceliksel analizini içerir. Bu süreçte tespit edilen maddeler cihazın klinik kullanımı, maruz kalma koşulları (örneğin cihazın invaziv olup olmaması, temas süresi gibi) ve maruziyet dozu gibi faktörleri dikkate alan bir toksikolojik risk değerlendirmesi yoluyla değerlendirilir.
Malzeme karakterizasyonunun, herhangi bir biyolojik test yapılmadan önce gerçekleştirilmesi önemlidir. Bu karakterizasyona dayanan toksikolojik risk değerlendirmesi, ISO 10993-1'de belirtilen bazı sonlanım noktaları ile ilgili olarak cihazın güvenliğini kanıtlayabilir. Böylece, bazı biyolojik testlerin gerekliliği ortadan kalkabilir. Toksikolojik risk değerlendirmesi yoluyla gerekçelendirilebilecek bu sonlanım noktaları şu şekilde listelenebilir:
- Akut toksisite
- Subakut toksisite
- Subkronik toksisite
- Kronik toksisite
- Karsinojenisite
- Genotoksisite
- Üreme ve gelişim toksisitesi
Kimyasal karakterizasyon ve toksikolojik risk değerlendirmesi, üretici için başka faydalar da sağlayabilir. Cihaz malzemelerinde tasarım değişikliği (tedarikçi değişikliği dahil) gerçekleştiğinde, var olan biyolojik test sonuçları, tasarımı değişmiş olan cihaz veya malzemeler için geçerli olmayabilir. Bu gibi durumlarda, ISO 10993-1'e göre gerekli olan testleri tekrarlamak gerekebilir. Ancak, kimyasal karakterizasyon verileri mevcutsa, üretici yeni cihaz üzerinde yeni bir karakterizasyon yaparak eşdeğerliliği bilimsel olarak gösterebilir. Bu şekilde biyolojik testleri tekrarlama gerekliliği ortadan kalkabilir.
Literatür Taraması
Biyolojik değerlendirme sürecinin diğer bir önemli adımı, hem malzeme seçimi hem de toksikolojik risk değerlendirmesinde kritik bir rol oynayan literatür taramasıdır. Literatür taraması yapmak, yayınlanmış çalışmalarda mevcut verilerin cihazın biyolojik güvenliğini sağlamak için yeterli olup olmadığını belirlemeye yardımcı olur; böylece ek test ihtiyacı ortadan kalkabilir. Aynı zamanda, literatür taraması mevcut verilerdeki eksikleri ortaya çıkarabilir ve daha fazla test yapılmasının gerekli olduğunu gösterebilir.
Biyolojik Testler
Biyouyumluluk testleri in vitro veya in vivo olarak yapılabilir. Bazı durumlarda, biyolojik güvenliğin kanıtlanması için hayvan testleri gereklidir. Eğer mümkünse, literatür taramaları, toksikolojik risk değerlendirmeleri veya in vitro test yöntemlerinin tercih edilmesi gibi alternatif yaklaşımlar kullanılarak hayvan testlerinin en aza indirilmesine yönelik çabalar gösterilmelidir.
Sonuç olarak, riski olmayan bir tıbbi cihazdan bahsetmek, genelde mümkün değildir. Tıbbi cihaz tasarımı sırasında, klinik kullanım ile ilgili potansiyel riskler, hastalara sunduğu sağlık faydaları ile dengelenmelidir. Bu nedenle, biyolojik güvenlik çalışmalarının sonuçları, uygun bir fayda-risk kapsamında yorumlanmalıdır. ISO 10993 standart serisi, risk yönetimi ilkeleri doğrultusunda, tıbbi cihazların biyolojik güvenliğini değerlendirmek için yapılandırılmış bir çerçeve sunar.




