SCHEER’in “Karsinojenik, mutajenik, üreme için toksik (CMR) veya endokrin bozucu (ED) özelliklere sahip tıbbi cihazlarda ftalatların yarar-risk değerlendirmesiyle ilgili güncellenmiş kılavuzu”na Genel Bir Bakış
SCHEER (Scientific Committee on Health, Environmental and Emerging Risks), tıbbi cihazlardaki ftalatların yarar-risk değerlendirmesi ile ilgili kılavuzunun güncellenmiş bir versiyonunu yayınlamıştır. Bu kılavuz, kanserojen, mutajen veya üreme sistemine toksik etki gösteren madde (CMR) olarak sınıflandırılmış veya endokrin bozucu (ED) özelliklere sahip ftalatlara değinmektedir. İlk versiyonu 2019'da yayımlanan bu kılavuz, beş yıl sonra ilk kez revize edilmiştir.
Kılavuzun Amacı
SCHEER’in yayınladığı kılavuz, MDR’nin Ek I, Bölüm 10.4'te belirtilen gerekliliklere açıklık getirmeyi amaçlamaktadır. MDR’nin 10.4.1’e göre, 1A veya 1B kategorisinde CMR veya ED maddelerin, ağırlıkça % 0,1’i aşan konsantrasyonlarda tıbbi cihazlarda kullanımı, yalnızca uygun bir gerekçe sağlanırsa kabul edilebilmektedir.
SCHEER kılavuzu, CMR 1A veya 1B ve/veya ED ftalatların %0,1’in üzerindeki konsantrasyonlarda kullanımına ilişkin bir yarar-risk değerlendirmesi yönteminden bahsetmektedir. Kılavuz ayrıca, bu ftalatların alternatif malzemeler, tasarımlar veya tıbbi tedavilerle değiştirilmesini değerlendirme sürecini de anlatmakta ve yol göstemektedir.
Kılavuzda Neler Güncellendi?
Kılavuzun ilk revizyonu, en son mevzuat değişikliklerini ve güncel literatür incelemesini dikkate almaktadır. Kılavuz, ftalatların ftalik asit esterleri olarak kimyasal profillerini içerecek şekilde genişletilmiştir. Yöntemler başlığı altında, kanıt kaynakları ve SCHEER’in Kanıt Ağırlığı (WoE) yaklaşımı açıklanmıştır.
Aynı zamanda, ftalat alternatiflerinin değerlendirme yöntemi de güncellenmiştir. Ftalat alternatifleri için kullanılan terminoloji “potansiyel olarak uygun” yerine “en uygun” adaylara odaklanacak şekilde değiştirilmiştir. Bu değişiklik, değerlendirme yapma için en az üç alternatif incelenmesini önermektedir. Ayrıca kılavuz, ISO 10993-18’e dayalı olarak tıbbi cihaz bileşimlerinin karakterize edilmesi gerektiğinden de bahsetmektedir.
Kılavuz, endokrin bozucu maddeler için Kategori 1 (bilinen veya varsayılan bozucular) ve Kategori 2 (şüpheli bozucular) sınıflandırmalarını tanıtmaktadır. Son olarak, “Ekler” kısmında CMR/ED ftalat alternatiflerine maruz kalma, sağlık tehlikeleri ve kan torbaları için yeni CMR/ED ftalat alternatiflerine dair üç yeni bölüm bulunmaktadır.
Ftalatlar Nedir?
Ftalatlar, polimerler için plastikleştirici olarak çeşitli endüstrilerde yaygın olarak kullanılan ve kaplamalı kumaşlar, çatı membranları ve özellikle tıbbi cihazlar gibi ürünlerde uygulama alanı bulan kimyasallardır. Yapıştırıcılarda, boyalarda, mürekkeplerde ve enterik kaplı tabletlerde de kullanımları bulunmaktadır. Tıbbi cihazlarda en çok kullanılan ftalatlardan biri olan Di-(2-etilheksil) ftalat’ın (DEHP), plastikleştirilmiş polivinil klorür (PVC) içindeki tipik konsantrasyonu ağırlıkça %30 ila %40 arasındadır. Diğer ftalatlar ise, dimetil ftalat (DMP) ve dietil ftalat (DEP) gibi, plastikleştirici olarak değil, kozmetik, tıbbi cihazlar ve ev ürünlerinde katkı maddesi olarak işlev görmektedir.
Pek çok ftalatın üreme toksisitesi ve endokrin bozucu etkileri bilinmektedir ve CLP, REACH ve MDR gibi mevzuatlar kullanımlarını kısıtlamaktadır.
CMR/ED Ftalatların Yarar-Risk Değerlendirmesi ve Gerekçelendirilmesi
CMR/ED ftalatların tıbbi cihazlarda kullanımını değerlendirirken, alternatiflerin yalnızca farklı maddeler veya malzemelerle sınırlı olmadığı dikkate alınmalıdır. Alternatifler, cihaz tasarımları (kaplama yöntemleri, üretim süreçleri veya maddelerin daha düşük konsantrasyonlarının kullanılması gibi) ve hatta alternatif tıbbi tedaviler veya prosedürleri dahi içerebilir. Bu alternatifler, CMR/ED ftalatların kullanımını tamamen ortadan kaldıracak teknik değişiklikler ve alternatif maddelerin bir kombinasyonunu içerebilir. Seçilen alternatif, cihazın performansında veya alternatif tıbbi prosedürün sonucunda klinik açıdan önemli bir farklılık olmaksızın benzer işlevsellik ve performans sağlamalıdır. Bu değerlendirme, bilimsel gerekçelere dayanmalıdır. Bir CMR 1A veya 1B ve/veya ED ftalatı tıbbi cihazda kullanmaya devam etmek isteyen üretici, belirlenen alternatiflerin cihazın işlevselliğini, performansını ve yarar-risk dengesini korumak için uygun olmadığını açıkça göstermelidir.
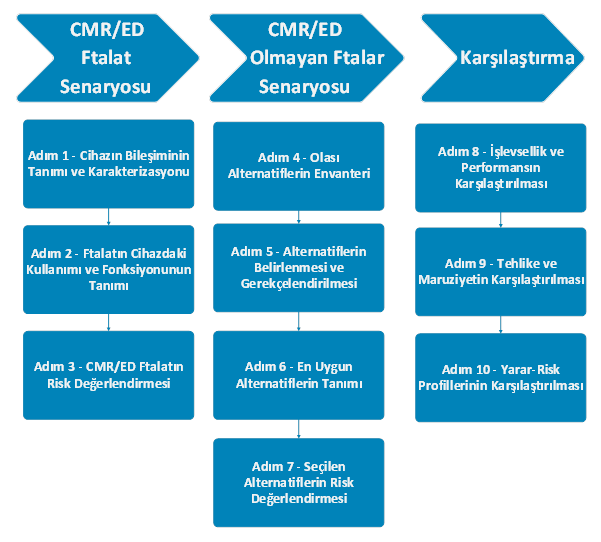
CMR/ED ftalatın %0,1’den daha yüksek konsantrasyonlarda tıbbi cihazda bulunmasını gerekçelendirmek için, birden fazla senaryo değerlendirilmelidir. Değerlendirme, 3 ana aşamadan oluşur. CMR/ED Ftalat Senaryosu'nda, CMR/ED ftalatlarının varlığı ve konsantrasyonu, bunların işlevi, performansı ve klinik faydaları tanımlanmalıdır. Bir risk değerlendirmesi ile, hastanın maruz kalma düzeyini, biyouyumluluğu ve CMR/ED ftalatının tehlikeleri belirlenmelidir. CMR/ED olmayan Ftalat Senaryosu'nda ise, tıpkı ilk senaryodaki gibi potansiyel alternatifler listelenmeli, tanımlanmalı ve risk değerlendirmesi yapılmalıdır. Son olarak, her iki senaryo, işlevsellik, performans, tehlikeler ve maruz kalma riskleri açısından karşılaştırılmalıdır. Cihazda CMR/ED ftalatının kullanımının genel fayda-risk dengesi, en uygun alternatiflerin fayda-risk profilleriyle karşılaştırılmalıdır.
Özetle, nihai karar, CMR/ED ftalat ile potansiyel alternatifleri arasındaki işlevsellik, performans, erişilebilirlik, riskler ve yararlar açısından kapsamlı bir karşılaştırmaya dayanmalıdır. CMR/ED ftalatların kullanımını gerekçelendirmek için öne sürülen argüman, alternatif bir madde, malzeme, tasarım veya tedavinin, tıbbi cihazın işlevselliğini ve yarar-risk profilini sürdürmek için neden uygun olmadığına açıklık getirmelidir. Bu doğrultuda, yarar ve risklerdeki farklılıkların önemini değerlendirilmeli, CMR/ED ftalatın alternatiflere göre kullanımı gerekçelendirilmelidir. Çocuklar, hamile veya emziren kadınlar ve diğer hassas hasta grupları gibi yüksek risk gruplarına özel olarak dikkat gösterilmelidir.




